期數:台中市糖尿病共同照護學會季刊第51期
作者:國軍花蓮總醫院家醫科 陳杰 醫師
出版日期:2019-09
英文關鍵字:physical activity、cardiorespiratory fitness、obesity、diabetes、insulin resistance
中文關鍵字: 胰島素阻抗性、代謝症候群、脂肪(細胞)激素、肌肉激素、肥胖
摘要
非傳染性疾病(Noncommunicable Diseases, NCDs)是目前全球人類健康的最大威脅,抽菸酗酒、不健康飲食與缺乏運動是NCDs四大危險因子1(Leal et al., 2018),預估到2020年時全球人類非傳染性疾病死亡率將占全人類死亡人數的72.5%,台灣106年十大死因中非傳染性疾病死亡率已經占所有死亡人數的70%左右,1975年以來,世界肥胖人數已增長近三倍。2016年,18歲及以上的成年人中逾19億人超重,其中超過6.5億人肥胖。2016年,18歲及以上的成年人中39%超重,且13%為肥胖。世界多數人口所居住的國家,死於超重和肥胖的人數大於死於體重不足的人數。2016年超過3.4億名5-19歲兒童和青少年超重或肥胖8。1975年以來,世界肥胖人數已增長近三倍。1993-2014年台灣19歲以上成年人調查結果,病態肥胖BMI>35、中度肥胖BMI:30-35、輕度肥胖BMI:27-30、過重BMI:24-27、正常人BMI:18.5-23.9、過輕BMI<18 8(Chang et al., 2017)。
病態肥胖者飲食型態:較常攝取紅肉、加工動物性食品、甜飲料,同時較少攝取新鮮水果、核果、燕麥與乳製品等。病態肥胖者有低教育程度、低個人收入與低身體活動量的傾向9。
運動可以使脂肪細胞分泌細胞激素,降低胰島素阻抗
脂肪細胞僅被認為是貯存能量的場所,近年來有許多研究證實脂肪細胞的代謝活躍,脂肪生成與分解的活性均很高,並且成熟的脂肪細胞可以分泌許多具有自泌素(autocrine)、旁泌素(paracrine)、內分泌素(endocrine)以及細胞激素(cytokine)效能的產物,如:leptin(瘦體素)、adiponectin、tumor necrosis factor α(TNF-α)、resistin和Angiotensinogen…等。這些細胞生物因子可以藉由不同的機制來調節脂肪細胞的發育與全身的代謝;透過運動的過程除了形成直接的能量負平衡外,其引發的激素調節作用亦可能具有健康效益。Boström et al.在2012年發現了新的肌肉激素Irisin係透過運動刺激骨骼肌分泌,促使脂肪產生棕色化(browning)的現象而產生熱量,消耗人體內的能量,或可調節骨骼肌細胞本身的生理代謝作用99。綜合目前探討運動介入對irisin之效應的文獻可得,相較於運動訓練,單次運動較能使irisin濃度提升,此現象可能與代謝恆定及適應有關;持續時間介於30分鐘至1小時,或強度較高之運動,多能顯著提升運動後立即或短時間內的irisin濃度,而約在運動後1小時回復至基礎值。基於目前各項研究結果,需持續探討irisin的生理機制,此外,運動後肌肉損傷對irisin之影響,及irisin在運動能量代謝上的實際作用,皆仍有待釐清。
脂肪組織增大,不一定會轉變成代謝功能異常,代謝功能異常現象:脂肪細胞體積變大、發炎指標物質上升、儲存之職能力下降、胰島素敏感度下降10。與體重正常健康者比較,代謝功能正常之肥胖者,罹患心血管疾病與危險指標物質(如:TG, LDL…)之相對風險仍然比較高。代謝功能正常之肥胖不是無害,肥胖本身就是一種疾病(Santovito et al., 2017)。與正常體重代謝功能正常者比較,體重正常代謝功能不正常與肥胖者代謝功能正常者,罹患冠狀動脈疾病、腦血管疾病風險與心臟衰竭風險均較高(Sturgiss et al., 2018)。在氧化壓力下,這些脂肪會釋放局部細胞激素造成發炎反應與器官失能,如:脂肪浸潤肝臟,造成脂肪肝(fatty liver)或非酒精性脂肪肝疾病(nonalcoholic fatty liver disease, NAFLD),進一步導致非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)。
脂肪肝與胰島素抗性、高血脂症、肥胖、代謝症候群

與代謝功能正常且BMI正常者(BMI:18.5-23.9)相比,代謝功能正常而肥胖者(BMI>30),得到冠心症、腦血管疾病、和心衰竭的風險分別為49%、7%、96%;而代謝功能異常但BMI正常(BMI:18.5-23.9)的成人,得到冠心症、腦血管疾病、心衰竭的風險則分別為66%、38%、45%;本文獻的代謝功能異常定義為血脂異常(dyslipidemia)、高血壓(hypertension)、第2型糖尿病(T2DM);由此可知「代謝異常的瘦子」會增加CHD(冠心症)及CVA(腦血管疾病),但是並不會增加(反而下降)CHF(心臟衰竭)的機率。因此心血管疾病之風險大小,依次為代謝功能不正常且肥胖者>代謝正常的肥胖者>健康體重、代謝正常者。整合分析10篇有關體重、體適能與總死亡率的研究,研究的對象族群中,與體適能程度,分成6組:正常體重,體能差者與正常體重但體能佳者、以及體重過重(overweight),體能差者、體重過重但體能佳者、肥胖(obesity)且體能差者、肥胖但體能佳者,研究結果如下結論:與正常體重體適能佳者相比較,不管BMI多大,體適能差者,均有2倍的總死亡風險。過重與肥胖者體適能佳者,總死亡風險與正常體重,體適能佳者類似。肥胖但體適能佳者,死亡風險不會明顯增加(fit individuals)。未來可供研究人員、臨床醫護人員、以及公共衛生政策的推動者,藉由運動來達到健康促進,降低總死亡風險,並且可以聚焦於身體活動與體適能的介入,而非一味只著重在減輕體重方面。因此fit(體適能)比BMI或肥胖更能反映總死亡率。心肺適能以最大攝氧量為基準(maximal oxygen consumption, VO2max, mL/kg/min),低於下列年齡層的最大攝氧量,為低心肺適能者(unfit)33(Ortega et al., 2017)。
表一、各年齡層的最大攝氧量(低於此數值要考慮亞健康狀態)
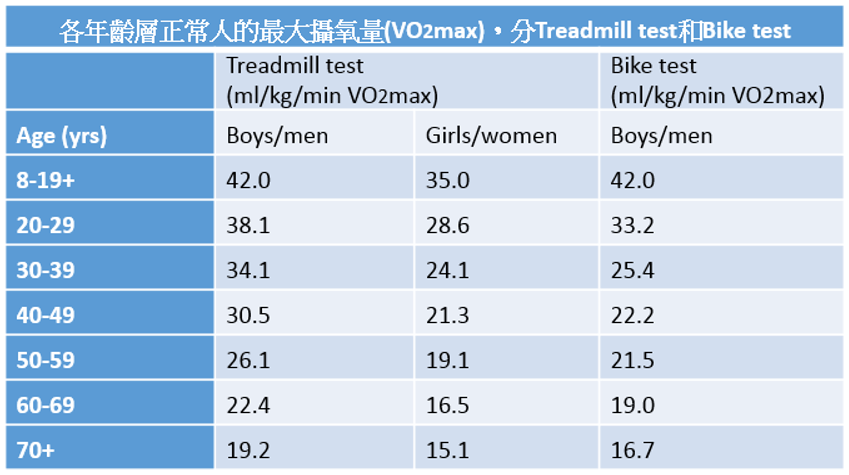
無論BMI、體脂肪與腰圍大小,只要心肺適能佳者,男性以及女性心血管疾病與總死亡風險都會比較低(Ortega et al., 2017)。肥胖與體能指數(Fit Fat Index, FFI)=心肺適能除以腰圍與身高的比值(cardiorespiratory fitness divided by waist-to-height ratio)。自1999年~2006的七年間的追蹤1206位(年齡介於20至85歲)成年人,Kaplan-Meier survival curve研究結果發現正常FFI為13,每增加1個單位,總死亡風險減少6%,已罹患心臟冠狀動脈疾病者-6%、心臟衰竭-5%、心肌梗塞-4%(Frith & Loprinzi, 2017)。
健康的脂肪組織可對抗全身性發炎反應
人體的典型身體組成,包括:脂肪組織,主要由脂肪細胞組成;瘦肉組織或稱非脂肪組織,則由肌肉、骨頭、內臟組織、水、結締組織、神經…等組成,脂肪組織男生約佔全身體重2-4%、女生約占10-12%,為神經、心臟…等各種細胞的細胞膜與荷爾蒙…等正常生理功能運作所需儲存脂肪:儲存於皮下、內臟、骨髓…等20。人體脂肪組織更替速度:每年約10-12.5%21。人體脂肪組織的種類:白色脂肪、色脂肪位置:皮下、腹部、腸道內臟周圍等組成:脂肪幹細胞、成熟脂肪細胞、神經、血管、白血球、淋巴細胞、巨噬細胞、免疫細胞…等22。白色、棕色脂肪組織、皮下、血管周邊、心臟外圍、肝臟、腹部內臟腸道周圍與骨髓脂肪組織…等(Fuster et al., 2016)。研究證實,內臟脂肪組織堆積是心血管及代謝疾病之重要風險因素,而皮下脂肪似乎是中性或有保護性,但其他儲存在心臟周邊,血管旁空隙,骨髓中的脂肪組織,這些組織的功能目前無法得知。棕色脂肪組織儲存在鎖骨上,和脊椎旁區域,與白色脂肪組織生理功能相反,棕色脂肪組織是代謝活耀的,利用身體儲存的醣類產生熱能;此外其他部位脂肪組織,堆積在肝臟,造成個體代謝功能不良;研究證實脂肪組織當中由50-70%成熟脂肪細胞、1-10%神經血管、20-40%脂肪幹細胞、1-30%巨噬細胞或其他免疫細胞所組成(Awada et al., 2013),人體出生後至青春期前,脂肪組織發展主要是脂肪細胞數量增生(hyperplasia)。青少年至成年期脂肪組織增加,則主要是脂肪細胞體積增大(hypertrophy)(Rodríguez et al., 2015)。體脂肪愈高,入侵脂肪組織的發炎細胞就會愈多,脂肪組織因而出現缺氧與發炎愈嚴重。內臟脂肪異常(ectopic fat)堆積在肝臟、胰臟、肌肉、心臟,會提高胰島素阻抗性及第2型糖尿病、心血管疾病的風險(Gaggini et al.,2015)。心肌外圍的脂肪組織,與其他內臟脂肪組織,有解剖與代謝功能特性上的差異,例如有較高的脂肪酸代謝功能、較多特定的發炎與血管內皮功能轉錄物組(transcriptome)基因。心肌外圍的脂肪組織與心臟肌肉共同使用血流循環,可見兩者間之互動關係緊密(Iacobellis, 2015)。在正常健康情況下,心肌外圍脂肪組織具有代謝、產生熱能與避震緩衝保護心臟作用。一旦心肌外圍脂肪細胞變大,脂肪組織發展出病理現象,就會對心肌與冠狀動脈造成傷害(Iacobellis, 2015)。血管外周邊脂肪組織(Perivascular adipose tissue, PVAT)會分泌發炎激素,有發炎細胞進入血管外周邊脂肪組織。血管外周邊脂肪組織也會分泌活性氧自由基(reactive oxygen spices, ROS),一氧化氮(nitric oxide, NO)、血管張力素-II (angiotensin II)與游離脂肪酸。有動脈粥狀硬化斑的血管周邊脂肪組織脂聯素表現(expression of adiponectin)會減少(Tanaka & Sata, 2018)。從血管外周邊脂肪組織分泌的脂肪細胞激素(Adipocytokines),經由擴散或供應冠狀動脈血管營養物質的微血管(vasa vasorum),直接通過相鄰的血管壁(Tanaka & Sata, 2018)。肥胖者脂肪組織會入侵促進發炎的巨噬細胞,與其他活躍的發炎細胞,這些細胞會增加腫瘤壞死因子(tumor necrosis factor-alpha, TNF-α)與介白素-6(interleukin-6, IL-6)…等發炎物質的分泌,而這些發炎物質會進一步經由內分泌與旁分泌的作用,促進與肥胖有關的結腸癌(colon cancer)的發生(Osório-Costa & Carvalheira, 2013)。雖然胰島素阻抗的調控因子尚不清楚,但目前已知運動可以抑制這個過程(Argente-Arizón et al., 2015)。動物與人體研究都證實:肥胖會傷害腦部認知功能;老化與高脂肪飲食,會促使骨髓間質細胞(mesenchymal lineage)傾向製造脂肪幹細胞,因而破壞骨質重建與骨折修護(Thomas et al., 2017)。研究發現內臟脂肪組織量增加,會提高肥胖有關的心血管疾病風險,而皮下脂肪量增加,則不會提高心血管疾病風險(González-Muniesa et al., 2017),抗發炎與促發炎脂肪激素(adipokine)失衡,同時也會影響到重要的代謝組織器官如:肝臟、骨骼肌…等功能與微血管結構,引發胰島素阻抗,間接促進心血管疾病的發展(Fuster et al., 2016)。
糖尿病患者缺乏運動,而僅藉由飲食控制的缺點:
一、過度限制熱量攝取:皮下脂肪與內臟脂肪組織會減小,但骨髓內脂肪組織會增加,同時會增加抗發炎脂肪激素分泌,因而增加感染疾病的風險。
二、體型正常:IL-4、IL-10、IL-13與TGF-b維持M2巨噬細胞生理型態與正常代謝與免疫功能恆定(homeostasis)。
三、體型肥胖狀態:脂肪細胞肥大促進細胞凋亡,M1巨噬細胞圍繞壞死脂肪細胞型成冠狀結構,促發炎激素與脂肪激素分泌增加,誘發全身性的發炎,引發肥胖相關疾病50(Mancuso, 2016)。
肌肉量太少(俗稱肌少症)對健康的威脅:降低10%免疫功能,增加感染風險,降低20%肌力、降低傷口修復能力、增加感染風險,增加30%坐姿困難、壓瘡、肺炎、傷口恢復困難,減低40%免疫力,增加死亡風險,通常是肺炎51。體重過輕的風險:生長遲緩,注意力不集中,免疫低下、感染,骨質疏鬆,氣胸,貧血,月經失調,不孕,心血管疾病,猝死…等。
運動會使白色脂肪組織(WAT)轉變棕色脂肪(BAT)
白色脂肪組織主要負責將能量以脂肪形式儲存起來,棕色脂肪組織主要負責產生非顫抖生熱作用(non-shivering thermogenesis)製造熱能,維持體溫(Contreras et al., 2016)。孩童與成人棕色脂肪組織分布位置。胸腔血管周邊脂肪組織(thoracic perivascular adipose tissue, PVAT)對冷與鳶尾素…等激素的刺激後,會呈現製造熱能(thermogenesis)的獨特功能,對維持血液溫度具有重要的作用57(Brown et al., 2014)。白色脂肪組織會棕色化淡棕色或棕色脂肪組織也會白色化58。運動訓練會增加皮下脂肪的淡棕色脂肪細胞含量,重新建構皮下脂肪組織,並增加分泌具有並提升肌肉與棕色脂肪組織氧化與代謝功能的脂肪激素(Wallberg-Henriksson & Zierath, 2015)。運動誘導肌肉分泌肌肉激素Myokine、鳶尾素Irisin,將白色脂肪棕色化(Leal et al., 2018)。運動時肌肉分泌的β-胺基異丁酸(β-Aminoisobutyric Acid, BAIBA),也有將白色脂肪棕色化的功能,另外BAIBA也有促進肝臟脂肪氧化(hepatic β-oxidation)的作用,這些與心臟代謝疾病風險呈現負相關現象61,62(Roberts et al, 2014)。運動時肌肉分泌犬尿胺酸轉胺酶(kynurenine aminotransferase, KAT)將因壓力產生的犬尿胺酸(Kynurenine),轉成犬尿酸(kynurenic acid),除了有去毒作用,同時也有將白色脂肪棕色化作用產生熱能、提升脂肪代謝、降低發炎(Agudelo et al., 2018)。運動訓練可以活化kynurenine,在骨骼肌透過生物轉換為kynurenic acid(KYNA),保護神經細胞免於發炎,使周邊堆積kynurenic acid(KYNA),kynurenic acid(KYNA)可以增加能量利用,藉由活化G protein-coupled receptor(GPR35接受器),GPR35接受器在脂肪組織中刺激脂肪代謝,產生熱量,以及脂肪組織中抗發炎基因的表現。運動時肌肉分泌的肌肉激素包括介白素6(IL-6)、鳶尾素(Irisin)、meteorin-like(metrnl)、β-胺基異丁酸(β-Aminoisobutyric Acid, BAIBA)、纖維母細胞生長因子21(FGF-21)…等(Rodrıguez et al, 2017),與心肌分泌的利鈉胜肽(natriuretic peptide, BNP)、交感神經分泌正腎上腺素(norepinephrine),都具有將白色脂肪組織棕色化作用(Ruiz et al., 2015)。
糖尿病患者透過運動訓練脂肪組織的功能
運動訓練刺激白色脂肪組織製造的脂肪激素,會對肌肉、肝臟與棕色脂肪組織等各組織器官產生內分泌的作用,改善全身的代謝功能與白色脂肪組織本身的功能(Stanford et al., 2015)。抗發炎脂肪激素(包括:adiponectin, FGF21 and SFRP5),可以經由冷的暴露與運動刺激增加分泌,促進白色脂肪組織解偶蛋白-1表現與白色脂肪組織棕色化。同時抗發炎脂肪激素可以產生全身性的代謝適應,減緩肝臟、肌肉與胰臟脂肪與糖類的代謝障礙,改善全身胰島素敏感度(Oh et al., 2017)。
運動時分泌肌肉激素對全身器官的影響
表觀遺傳的過程中,DNA甲基化以及histone的修飾都會影響健康,導致癌症,自體免疫疾病,神經系統疾病或糖尿病(Brown. 2015)。肌肉激素對骨骼肌的局部作用,運動誘導的肌肉細胞因子可以藉由自泌(autocrine)方式和旁分泌(paracrine)的方式調節肌肉的生理功能;肌肉細胞因子特殊的角色,對肌肉細胞的代謝和肌肉細胞的生長的特定作用,向下游調控機制、訊息傳遞路徑已知的一些情況下,可以見到肌肉激素的影響效果(Huh, 2018)。來自脂肪組織的脂肪細胞因子,和骨骼肌分泌的肌肉細胞因子,參與不同訊息傳遞路徑之間的關係(Huh, 2018);有一些細胞激素既可以分泌自骨骼肌,也可以分泌自一些脂肪組織(例如:IL-6,TNF-α),可同時由脂肪細胞和肌肉細胞皆分泌,並參與脂肪組織和骨骼肌肉組織兩者之間的聯結(Li et al., 2017)。腹部肥胖者運動介入可以減去內臟脂肪組織,透過IL-6受器傳遞訊息(Wedell-Neergaard et al., 2018);長期和短期運動的好處,身體產生細胞激素,減少內臟脂肪。Myokines參與和運動所引起的肌肉-脂肪組織,相互藉細胞激素對話;例如:Myostatin, FNDC5/Irisin,Myonectin,ngiopoietin-likeprotein(ANGPTL),b-aminoisobutyric acid(BAIBA), Interleukin-6(IL-6), Fibroblast growth factor 21(FGF21), Interleukin-15(IL-15)(Leal et al., 2018)。除了自體分泌、旁分泌外,肌肉激素也會作用在脂肪組織、肝臟、腸胃道、胰臟、骨頭與血液循環中或駐紮於組織中的免疫細胞與腫瘤組織…等(Hoffmann & Weigert, 2017)。
—待續52期–
